什么是毛细管电泳?
毛细管电泳(capillary electrophoresis, CE)又叫效毛细管电泳(HPCE), 是近年来发展快的分析方法之。效毛细管电泳是类以毛细管为分离通道、以压直流电场为驱动力的新型液相分析技术。毛细管电泳是将电泳的场所置于毛细管中的种电泳分离方法,它的装置结构通常由压电源、铂电、缓冲液池、样品池、毛细管、检测器和分析记录仪构成。
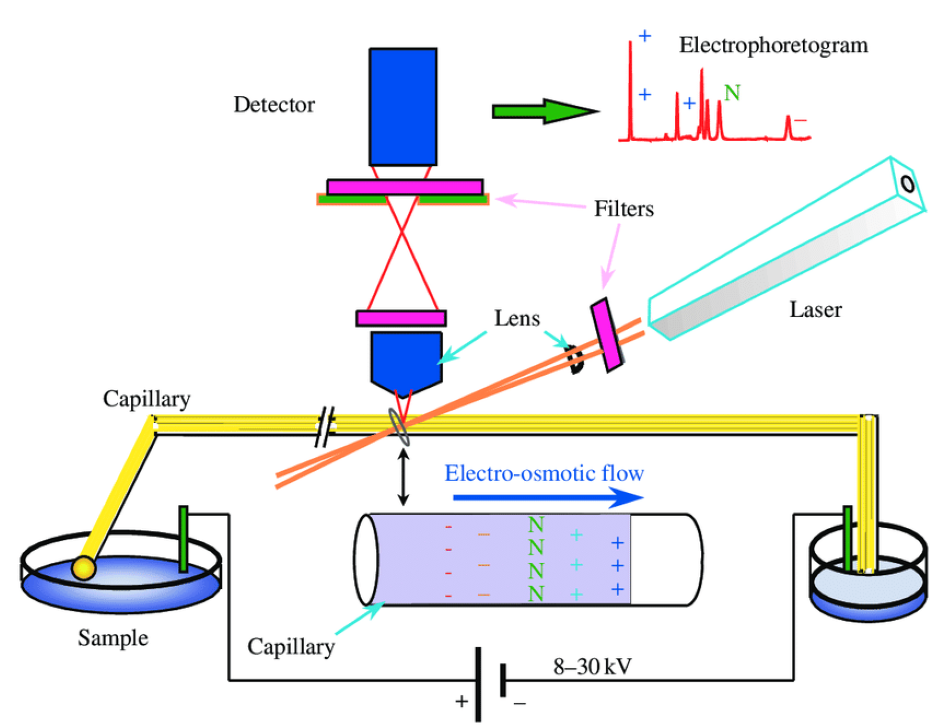
毛细管电泳的原理和过程是怎样的?
毛细管电泳分离的基本流程有进样、分离和检测三步骤。进样:毛细管电泳的基本装置是根充满电泳缓冲液的毛细管,与毛细管两端相连的两个小瓶微量样品从毛细管的端通过“压力”或“电迁移”进入毛细管;分离:电泳时,与压电源连接的两个电分别浸人毛细管两端小瓶的缓冲液中。样品朝与自身所带电荷性相反的电方向泳动。各组分因其分子大小、所带电荷数、等电点等性质的不同而迁移速率不同,依次移动至毛细管输出端附近的光检测器,检测、记录吸光度,并在屏幕上以迁移时间为横坐标,吸光度为纵坐标将各组分以吸收峰的形式动态直观地记录下来;检测:检测的原理基于被测组分和背景电解质的吸光度不同,当被测组分通过检测窗时,吸光度发生的变化服从朗伯-比尔定律,即在定的实验条件下,吸光度与被测组分的浓度成正比。
毛细管电泳和普通电泳相比较的势在哪里?
通常电流通过导体时都会产生焦耳热。传统平板凝胶电泳的大局限性在于,其无法克服两端电压带来的焦耳热所产生的负面影响。焦耳热可使筛分介质内部出现温度、粘度及分离速度的不均,影响迁移、降低效率、使区带变宽。由于这种负面影响与电场强度成正比,所以大地限制了电压的引入,也难以提电泳速度。毛细管电泳使样品在根细的柱子中进行分离。细柱可减小电流,使焦耳热的产生减少;同时又增大了散热面积,提散热效率,大大降低了管中心与管壁间的温差,减少了柱子径向上的各种梯度差,保证了效分离。因此可以加大电场强度,达到100~200V/cm,**提分离质量。

毛细管电泳主要用于哪些实验?
总的来说,毛细管电泳可用于对有机化合物、无机离子、中性分子、手性化合物、蛋白质和多肽、DNA和核酸片段的分析。具体来说,常见的应用范围有以下几个方面:
(1)速DNA测序:由于人类基因组工程的提出,速DNA测序引起了广泛注意,由于对核苷酸及其聚合物的分辨率,毛细管电泳在DNA测序中的应用潜力也受到重视。在电场和使用阵列毛细管条件下,其潜在的测序能力远远超过了现有方法。
(2)手性分离现代社会中,手性分析常牵涉到人类生命、动植物的生存和演化,在**研究和生产中也是必须考虑的问题,研究证明手性手细管电泳是简单效的手性分析方法。手性应用的研究包括异构体拆分、能度测定、反应动力学研究、手性**筛查等。
(3)蛋白质分析蛋白质分离分析也是毛细管电泳的主要应用方向,包括:蛋白和多肽的纯度分析、结构研究、结合蛋白的研究、生化及其过程分析、物化常数的测定,临床医学研究等。
(4)糖分析糖是自然界中广泛存在的化学物质,已发现的蛋白质中90%以上含有糖碱基;糖在细胞识别以及其它生物分子识别中也具有不可替代的作用。但是由于糖的些特殊性质,对它的分离分析有很大的困难。而近年发展起来的毛细管电泳仪用于糖的分析取得了巨大的成功,成为糖分离分析的有效工具。
(5)单细胞分析毛细管电泳既能研究许多细胞构成的样品,也能只研究单个细胞,即单细胞分析。单细胞分析技术为生命科学研究打开了新的天地,推动了系列的新研究的出现,已被广泛应用于生物学、**学、血液流变学、细胞生理学,临床医学,特别是肿瘤研究和器官移植。
(6)联用技术联用技术的研究将是毛细管电泳仪的重大发展方向之,与谱、质谱等方法的联用将会大大提毛细管电泳仪的应用范围。
毛细管电泳的基本操作
1.按照仪器操作规程开机,预热,输入毛细管卡套温度、操作电压、检测波长和冲洗程序等各项参数。缓冲液需过滤并脱气。冲洗液、缓冲液等放置于样品瓶中,依次放入进样器中。
2.毛细管处理的好坏对测定结果影响很大。未涂层的新毛细管要用较浓的碱液并在较高的温度(例如1 mol/L氢氧化钠溶液,60℃)冲洗,使毛细管内壁活化生成硅羟基,再依次用0.1mol/L氢氧化钠溶液、水及缓冲液分别冲洗数分钟。两次进样中间可仅用缓冲液冲洗,当分离性能改变时,必须用0.1 mol/L氢氧化钠溶液冲洗,甚至需要用浓氢氧化钠溶液升温冲洗。对于凝胶毛细管、涂层毛细管、填充毛细管电泳分析,应按照所附说明书进行冲洗。冲洗时,应将盛溶液的试样瓶依次置于进样器中,设定顺序和时间进行实验。
3.缓冲液的种类、pH和浓度,以及添加剂[提高待测组分的溶解度和(或)控制待测组分的解离度]的选择对测定结果有显著影响,应照各品种项下的规定配制,并根据预试结果进行调整、优化。
4.将供试品溶液瓶置于进样器中,设定进样压力(电动进样电压)、进样时间、正极端或负极端进样、操作电压或电流、检测器等操作参数,开始测试。可根据预试或适用性试验的电泳谱图调整仪器参数和缓冲液等参数优化分析条件,然后采用优化后的条件正式测试。
5.测试完毕后用水冲洗毛细管,注意将毛细管的两端浸入水中保存,如果长久不用应将毛细管用氮吹干,后关机。
6.由于进样方法的限制,目前毛细管电泳的精密度比用定量阀进样的高效液相色谱法要差,故定量测定以内标法为宜。用加压或减压法进样时,供试品溶液的黏度会影响进样体积,应使供试品溶液和对照溶液的黏度保持一致;用电动法进样时,待测组分因电歧视现象及溶液离子强度会影响待测组分的迁移量,也是影响精密度的主要因素。
毛细管电泳方法的影响因素
(一)缓冲液的选择
缓冲液的组成直接影响毛细管电泳分析的效果,缓冲液的种类、pH和浓度是为重要的影响因素。
缓冲液的种类应遵循下列原则:
,在选择的pH范围内具有良好的缓冲容量。
第二,在检测波长处的吸收低。
第三,自身淌度低,即分子大而荷电小,以减少电流(焦耳热)的产生。
在分离特殊性质的成分时,可采用不同的分离模式,通过在缓冲液中添加环糊精、十二烷基硫酸钠(SDS)可进行手性物质、中性物质的分离。
缓冲液的pH可影响不同酸碱性的待测组分的迁移速率。当缓冲液的pH低于组分的PI值时,组分带正电,向阴极迁移,与电渗流同向,因此,组分迁移的总速度大于电渗流;当缓冲液的pH高于溶液的PI值,情况相反,迁移的总速度低于电渗流。
缓冲液浓度的增加,使离子强度增加,能减少组分与和管壁、待测组分之间的相互作用,从而改善电泳分离效果。增加缓冲液的浓度提高柱效的同时,还应考虑扩散和黏度两个因素。随着缓冲液浓度的增大,分离电流也会上升,从而使焦耳热的产量加大,可能影响分离过程。
(二)进样方法
主要有流体动力进样和电动进样两种方式。
1.流体动力进样流体动力进样也称虹吸进样、压力进样或重力进样,是常用的进样方法。其优点在于如果样品的黏度和温度保持恒定,则进入毛细管的物质量将是固定的;进样过程中没有组分歧视效应。但是流体动力进样会引起杂质干扰、柱效降低的缺点。
2.电动进样电动进样又称电迁移进样,是通过改变进样电压和时间能对进样量进行控制的方法,进样量还与电泳淌度有关。因此,电迁移进样对迁移组分具有歧视效应的缺点,对淌度较大的组分进样量会大一些,反之则要小一些。
(三)分离电压
当柱长固定时,随着操作电压的增加,电渗流和电泳流速度的值都增加,使迁移时间缩短,但由于电渗流速度一般远大于电泳流速度,因此表现为组分的总迁移速度加快。总之,在一定的范围内柱效随电压的增加而增加,超过一定电压时,随着电压的增加,焦耳热的影响加剧,柱效反而下降。因此,在分析过程中可绘制电压一柱效曲线,选择佳的分离电压。
(四)柱温的选择
温度对迁移的影响可通过黏度体现,温度升高,溶液的黏度降低,导致EOF增大。多数情况下,较高的温度可缩短迁移时间。在流体动力进样时,通过增加温度可获得更大的进样量。因为温度既可影响化学平衡,又影响动力过程,还能影响蛋白质构型及蛋白质-DNA相互作用,因此可作为优化分离的重要控制参数。
毛细管电泳仪的注意事项
(一)仪器工作环境
温度一般为5~35℃,相对湿度一般小于65%。工作电压为交流电源220V。
(二)仪器操作注意事项
1. 2ml缓冲溶液瓶的液面高度不得低于1/2,也不可超过瓶颈。且瓶口和瓶颈内部不得沾有液体,如果有液体存在,应将瓶口和瓶颈内壁的液体清除再盖瓶盖;否则瓶盖易滑出,从而导致毛细管及电极的折断。瓶盖上的液体残留可能会导致漏电现象发生,当发现缓冲溶液瓶瓶盖上有液体时一定要立即清除或更换。
2.用于装废液的样品瓶要及时清理,过量的废液既会污染毛细管,也会造成气路的阻塞。
3. 缓冲溶液瓶瓶盖及样品瓶瓶盖均不可用洗涤剂长时间浸泡或放入烘箱烘干,否则会导致瓶盖的老化。此外,当样品瓶帽使用时间过长或被试剂腐蚀后,可能会出现失去弹性而变硬的情况,在此情况下应更换使用新的瓶帽。
4.应注意仪器的防尘、防潮,并经常对电极和接口进行清洁,避免因灰尘堆积造成漏电事故。







